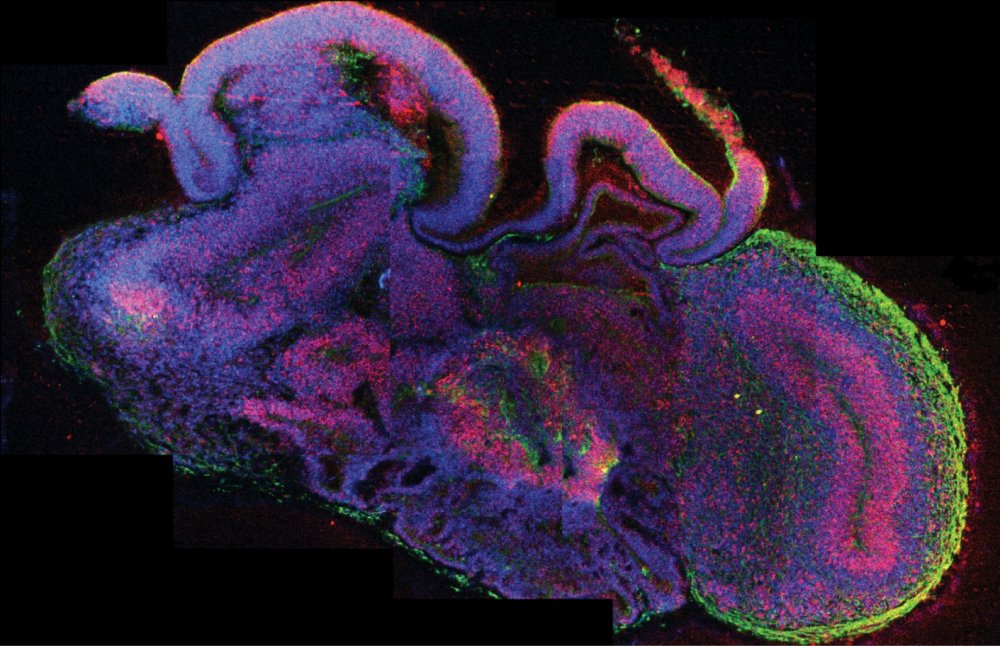
Sie sind nur wenige Millimeter klein, doch für die Zukunft der Medizin wird ihnen Großes prophezeit: Organoide. Die künstlich gezüchteten Mikrostrukturen halten in Laboratorien weltweit Einzug. Hierzulande wird am Institut für Molekulare Biotechnologie der Österreichischen Akademie der Wissenschaften (IMBA), das Jürgen Knoblich seit 2018 als wissenschaftlicher Direktor leitet, eifrig am nächsten Durchbruch in der Organoidforschung gearbeitet.
medinlive: Herr Knoblich, werfen wir einen Blick ins Labor. Wie entsteht ein Organoid?
Knoblich: Im Grunde gibt es zwei Methoden, um Organoide herzustellen. Eine Methode ist im Labor des Molekulargenetikers Hans Clevers am Hubrecht Institut in den Niederlanden entwickelt worden. Diese Methode verwendet adulte Stammzellen (Stammzellen, die in unseren Organen vorkommen, Anm.), um die Regeneration dieser Organe in Zellkultur nachzuahmen. Durch diesen Regenerationsweg können die Organe hergestellt werden. Diese Methode ist relativ einfach und in großer Menge anwendbar, sie hat aber zwei große Nachteile: Zum einen ist die Anwendung nur bei Patienten möglich, von denen vorher eine Gewebeprobe entnommen wurde. Zum anderen funktioniert die Methode nicht mit Organen, die sich nicht regenerieren können. Die Entwicklung des menschlichen Gehirns und die Entstehung von Krankheiten lassen sich damit allerdings nicht untersuchen.
Deswegen haben wir am IMBA eine Methode entwickelt, die aus induzierten pluripotenten Stammzellen (iPS-Zellen, Körperzellen, etwa aus einer Blut- oder Hautprobe, die nach einer Methode von Shinya Yamanaka zu Stammzellen umprogrammiert werden können, Anm.) Organoide herstellt. Bei dieser Methode schaltet man im Labor vier Gene ein, wodurch die Zellen in ihrer Entwicklung rückwärtsgehen, sie entwickeln sich zurück in den Zustand, in dem sie kurz nach der Befruchtung waren. Dann kann man diese Zellen im Labor wieder vorwärtsgehen lassen und in jede Zelle des menschlichen Körpers verwandeln. Das ist in der Zellkulturschale möglich, wir in unserem Labor bauen die Entwicklung eines Organs dreidimensional in dieser Zellkultur nach. So lassen sich etwa Nieren-, Lungen- und Herz-Organoide herstellen.
medinlive: Inwiefern unterscheiden sich Organoide von menschlichen Gehirnen?
Knoblich: Ein Organoid wird sich immer von einem menschlichen Gehirn unterscheiden; das muss man klar sagen. Was wir machen können: Wir fangen mit pluripotenten iPS-Zellen an und erzeugen daraus ein Neuroektoderm (das Neuroektoderm ist der Teil des äußeren Keimblatts/Ektoderm, aus dem sich in der Embryonalentwicklung das Nervensystem entwickelt, Anm.). Dann kommen die Organoide in eine Substanz namens Matrigel (eine komplexe Mischung von Biomolekülen, die in der 3D-Zellkultur als Wachstumsgrundlage - Matrix, Zellsubstrat - verwendet wird, Anm.), in der sie sich entwickeln. Dort kommen die Organoide in ein Stadium, in dem sie histologisch wie ein menschliches Gehirn aussehen, anatomisch allerdings nicht. Das ganze Organoid sieht nicht aus wie ein Gehirn, aber sehe ich mir nur eine kleine Region an, dann ist diese dem menschlichen Gehirn erstaunlich ähnlich. Diese Ähnlichkeit besteht bis ungefähr zum Ende des ersten, Anfang des zweiten Trimesters der fötalen Entwicklung. Ab diesem Zeitpunkt werden Organoide einem echten Gehirn immer unähnlicher.
Dennoch kann man Organoide mehrere Jahre kultivieren. Dabei werden die Zellen immer reifer und durchlaufen dieselben Reifungsprozesse, die eine menschliche Nervenzelle in der Embryonalentwicklung durchläuft. Hierzu gibt es mittlerweile Daten, die zeigen, dass man bis zum Ende der Embryonalentwicklung diesen Reifungsprozess der Nervenzellen steuern kann. Aber nach einem Jahr sieht ein Organoid überhaupt nicht mehr aus wie das frühe Stadium des menschlichen Gehirns - das ist ein Ball aus Zellen, wie Kraut und Rüben. Trotzdem ist es nützlich, denn ich kann untersuchen, was bei einem Patienten passiert: Haben die Zellen die richtigen Verbindungen? Schicken sie ihre Axone in die richtige Richtung, verdrahten sich die Regionen richtig? Ein Organoid ist jedenfalls kein menschliches Gehirn, sondern ein Modell eines menschlichen Gehirns, eine dreidimensionale Kultur, die die Eigenschaften eines menschlichen Gehirns hat. Der Begriff „Mini-Hirn“, der oft verwendet wird, ist sehr irreführend. Und das Wichtige dabei ist, dass wir für unsere Forschung auch kein ganzes menschliches Gehirn brauchen. Wie können bereits jetzt schon neurologische Krankheiten studieren.
medinlive: Am Beispiel von Autismus-Patienten: Wie könnte die Organoidforschung konkret aussehen?
Knoblich: Man nimmt etwa 20 Autismus-Patienten und 20 gesunde Patienten, stellt aus deren iPS-Zellen Organoide her und sieht sich dann systematisch an, wie sie zellulär zusammengesetzt sind, welche Zellen wo vorkommen und welche Gene eingeschaltet sind. Das kann man mittlerweile massenweise machen, 20.000 Zellen in einem Schlag, die mittels eines Verfahrens namens Single Cell Sequencing analysiert werden können. In diesem Bereich verspreche ich mir sehr große Fortschritte im kommenden Jahr.
medinlive: Welche Bedeutung hat die Organoid-Forschung für die medizinische Behandlung?
Knoblich: Die Organoidforschung ist noch relativ jung, rund zehn Jahre und noch nicht in der Klinik angekommen. Noch gibt es keine Organoid-Therapie bisher, auch wenn es bereits sehr gute Ergebnisse in der Forschung gibt. Im Augenblick liegt der Wert der Organoidforschung in erster Linie in der Forschung und darin, dass wir Krankheitsmechanismen direkt am Menschen untersuchen können, wie Schizophrenie oder Autismus, über die wir nur sehr wenig wissen. Die medizinische Forschung der vergangenen 30, 40 Jahre hat sich sehr stark auf Tiermodelle spezialisiert. Zwar können wir den Krebs in einer Maus 100.000 Mal heilen und das hat uns auch viel gelehrt, aber es entstand eine Wissenslücke bei all den Prozessen, die nur beim Menschen und nicht in Tieren vorkommen. Dazu gehören etwa Prozesse, die im Gehirn stattfinden. Unser Gehirn entwickelt sich fundamental anders als das einer Maus. Diese Prozesse können wir jetzt in den Organoiden untersuchen. Da erwarte ich mir in den nächsten fünf bis zehn Jahren ziemlich große Entdeckungen; da werden Organoide ordentlich einschlagen.
Ein weiterer großer Vorteil von Organoiden ist, dass der genetische Hintergrund bei der Reprogrammierung in den iPS-Zellen bewahrt wird, den kann ich niemals in einem Tiermodell nachmachen. So kann ich etwa feststellen, ob ein bestimmtes Medikament bei einem spezifischen Patienten wirksam ist oder nicht.
medinlive: Wann wird die Forschung an Organoiden bei den Patienten ankommen? Welche Bedeutung haben Organoide für die Medikamentenentwicklung?
Knoblich: In den letzten zwei bis drei Jahren wurden die ersten Firmen gegründet, die Organoide verwenden, um Medikamente zu entwickeln. Wie lange es dauert bis so ein Medikament entwickelt wird, lässt sich schwer sagen. Man kann davon ausgehen, dass es rund zehn Jahre dauert, bis so ein Medikament entwickelt wird und dann muss man nochmal fünf bis sechs Jahre für die finalen klinischen Studien einberechnen.
Es gibt schon jetzt Beispiele, in denen Organoide in der Klinik angewandt werden. Ein berühmtes Beispiel kommt aus den Niederlanden und dem Labor von Hans Clevers. Dort wurde an Patienten mit zystischer Fibrose geforscht. Die Ursache für die Krankheit ist ein Gendefekt namens CFTR. Während die verfügbaren Medikamente bei den meisten Patienten wirken, gibt es ein paar wenige Patienten, die einen anderen Defekt im gleichen Gen besitzen und die andere Medikamente benötigen würden. Die Medikamentenentwicklung für diese geringe Patientenzahl wäre unerschwinglich und die Krankenversicherung wollte dies nicht zahlen. Deswegen wurde ein Programm gestartet, bei dem bei allen Patienten, die in den Niederlanden unter diesem seltenen Gendefekt leiden, eine Biopsie gemacht wurde und aus dieser Probe Darm-Organoide hergestellt und Medikamente getestet wurden. Wenn die Behandlung der Organoide funktioniert, werden die Patienten damit behandelt und die Krankenkasse zahlt. Organoide werden klinisch angewandt, aber es gibt noch keine in der breiten Masse eingesetzte Therapie.
medinlive: Gibt es Studien, die Vergleiche von Organoid-Modellen und Tiermodellen anstellen?
Knoblich: Was die Forschung am Gehirn betrifft, ist die Anwendung ein ,no-brainer'. Das war auch Teil unserer Originalpublikation. Doch auch aus Tieren lassen sich Organoide herstellen. Mittlerweile gibt es einen ganzen Zoo. An Organoiden von Orang-Utans und anderer Primaten oder Makaken kann man lernen, wie die Evolution unseres Gehirns abgelaufen ist. Das ist ja auch eine Blackbox. Wir wissen ja auch nicht, was unser Gehirn menschlich macht und was passiert ist, damit unser Gehirn so leistungsfähig geworden ist. Das ist etwas, das bisher nicht erforscht werden konnte. Nun kann man untersuchen, welche spezifischen Gene im Menschen wofür verantwortlich sind. Die Forschung ist auch noch in den Kinderschuhen, aber hier werden einige Durchbrüche kommen in den nächsten Jahren.
medinlive: Welche Methoden werden eingesetzt, um Gehirn-Organoide größer, komplexer und haltbarer werden zu lassen?
Knoblich: Es gibt drei verschieden Methoden: Zum einen können wir Organoide mit anderen fehlenden Zellen mischen, etwa mit Blutgefäßzellen oder Mikrogliazellen. Die zweite Methode ist die Bioverfahrenstechnik. Da gibt es erfolgversprechende Ansätze, um Organoide in Kulturschalen zu halten, in denen Mikrokanäle enthalten sind, wo ich auf einer Seite Wachstumsfaktoren hinzufügen kann und auf der anderen Seite eben nicht. Die dritte Methode sind fusionierte Organoide. Will ich zum Beispiel Nervenbahnen nachbauen, die vom Mittelhirn in das Großhirn laufen, kann ich diese getrennt herstellen und fusionieren. Organoide kleben nämlich gerne zusammen. Dann werde ich sehen, dass die Nervenfasern zusammenwachsen. Das berühmteste Beispiel kommt von Madeline Lancaster (eine ehemalige IMBA Forscherin, die nun ihr eigenes Labor in Cambridge/UK hat, Anm.). Sie hat in meinem Labor diese Methodik etabliert. Sie hat ein Großhirn-Organoid hergestellt und mit Rückenmark und Muskeln (aus Ratten präpariert) co-kultiviert. So konnte sie zeigen, dass das menschliche Gehirngewebe den Rattenmuskel zum Zucken bringen kann. Die Verbindungen sind also absolut in Takt. Diese Methodik verwenden wir etwa um Rückenmarksverletzungen zu untersuchen.
medinlive: Wer treibt die Organoidforschung international voran?
Knoblich: Die iPS-Zellen Forschung kommt aus Japan mit den Wissenschaftlern Shinya Yamanaka und Yoshiki Sasai. Sasai hat angefangen an dreidimensionalen Kulturen zu forschen. Dier erste, der angefangen hat, an Organoiden Krankheiten zu forschen, war Hans Clevers in den Niederlanden. In Ütrecht ist auch ein Krankenhaus entstanden, das sich darauf spezialisiert. Wir am IMBA waren die Ersten, die gezeigt haben, dass man mit dreidimensionalen Kulturen aus iPS-Zellen Krankheiten simulieren kann. Am IMBA forschen mittlerweile fünf Gruppen an Organoiden. Unser Labor arbeitet mit Gehirn-Organoiden, Josef Penningers Labor mit Blutgefäß-Organoiden, eine Gruppe stellt Herz-Organoide her, eine andere Gruppe erstellt sogenannte Blastoide, welche die allerersten Schritte der menschlichen Entwicklung widerspiegeln und eine Gruppe erzeugt Darm- und Magen-Organoide. Darüber hinaus sind es international die üblichen Verdächtigen wie das MIT in Boston, die einen Schwerpunkt auf Organoide legen. Aber die Zahl der Forschungsgruppen, die weltweit mit Organoiden arbeitet, geht in die Hunderte. Es gibt viele Länder, die Institute zu diesem Bereich aufmachen wollen, in China und den USA gibt es bereits solche.
medinlive: US-Forscher haben in einem Experiment Organoide mit einem Roboter verbunden. Dann das Organoid über elektrische Impulse angeregt Signale an den Roboter zu schicken, die diesen dann steuern. Was halten Sie von solchen Experimenten?
Knoblich: Solche Versuche sind wenig sinnvoll. Das könnten zufällige Signale sein, die hier ausgetauscht werden. Was dagegen schon etwas bringt sind etwa Methoden, um eine große Anzahl an Nervenzellen gleichzeitig zu untersuchen. Dafür verwenden wir Mikroelektroden, also Stäbe, an denen bis zu tausend Elektroden hängen, von denen jede ein oder zwei Nervenzellen messen kann. Diese hängt man an einen Computer und kann dann Muster der Nervenzellererregung in einem Organoid ansehen. In jedem Fall ist das Wichtigste in der Forschung, dass man nach der Forschung Vergleiche zieht zwischen gesunden Patienten und kranken Patienten und dann Rückschlüsse auf diese Krankheit zieht.
medinlive: Um auf die ethische Debatte zu sprechen zu kommen: Wie lässt sich feststellen, ob Organoide ein Bewusstsein entwickeln können, wenn dieses Thema selbst beim Mensch nicht ausreichend erforscht ist?
Knoblich: Das ist genau das Problem. Wir haben keine klare Definition, aber wir wissen was es braucht, um ein Bewusstsein zu entwickeln. Da gibt es zum Beispiel Experimente, bei denen Probanden für Millisekunden Bilder eingeblendet werden. Auch wenn die Bilder nicht bewusst wahrgenommen wurden, haben sie trotzdem Einfluss auf das späteres Verhalten. Wenn ich nun die Bilder länger einblende, meldet der Proband zurück, dass er das Bild gesehen hat, dann ist es ihm bewusst geworden. Dann kann man die Gehirnströme messen. Dabei zeigte sich: War dem Proband das Bild unbewusst, wurde der visuelle Cortex angeregt. Sobald dem Probanden das Bild bewusst wurde, werden großräumige Verbindungen innerhalb des Großhirns angeregt. Was das Bewusstsein braucht, sind Verbindungen über lange Regionen in unserem Gehirn und die habe ich in einem Organoid nicht. Alles was man mechanistisch einem Bewusstsein zuschreibt, ist in einem Organoid nicht vorhanden.
Um ein Gedankenexperiment hier anzuführen: Bei Epilepsie gibt es Operationen, bei denen Patienten bestimmte Regionen des Gehirns entfernt werden. Diese Regionen können sehr groß sein. Nun müsste man sich überlegen: Ist das Bewusstsein in dem Menschen der übrig bleibt oder ist ein Teil des Bewusstseins jetzt in diese Probe gewandert, die der Chirurg entfernt hat? Niemand wird sagen, dass das Bewusstsein in die Probe gewandert ist, trotzdem sind diese Gewebestücke um ein vielfaches, größer, komplexer und besser verdrahtet als ein Organoid. Das sind für mich die Hauptargumente zu sagen, dass die Gefahr, dass ein Organoid ein Bewusstsein entwickelt, gegen Null geht.
medinlive: Sie sind als Berater und Mitglied von Forschungskomitees Teil der ethischen Debatte um Organoide. Welche Fragen werden dort gestellt?
Knoblich: Derzeit arbeite ich gemeinsam mit Neurobiologen, Philosophen, Ethikern und Juristen an der deutschen Akademie der Wissenschaften an einer Stellungnahme, bei der wir uns folgende Frage stellen: Was müsste passieren, damit wir sagen würden, jetzt ist Schluss mit der Forschung. Dabei kann herauskommen: Wenn jemand ein Organoid herstellt, das einen Meter Durchmesser hat, oder wenn ein Organoid anfängt sich zu bewegen. Das ist natürlich sehr unwahrscheinlich. Aber ich glaube, auch wenn wir als Wissenschafter keine ethischen Bedenken sehen, wenn es Bedenken in der Bevölkerung gibt, müssen wir uns damit auseinandersetzen. Das ist unsere Pflicht und das tun wir auch und ich mache das sehr aktiv sowohl in Deutschland, als auch hier in Österreich. In dem Komitee der Internationalen Gesellschaft für Stammzellforschung (ISSCR) sind wir gerade dabei die Richtlinien für Stammzellenforschung so umzuschreiben, dass sie Organoide ganz spezifisch abdecken und die ethischen Besonderheiten dieser Gehirn-Organoide mitberücksichtigen. In dem Ausschuss sitzen neben Europäern auch Japaner, Chinesen - was ich für besonders wichtig halte, immerhin ist China der größte Forschungsraum der Welt - und US-Amerikaner.
medinlive: Wie unterscheidet sich die ethische Debatte in Europa zu anderen Ländern?
Knoblich: In Europa ist die Debatte fundierter, geht tiefer und dauert länger. In den USA wird pragmatisch darüber nachgedacht, welche Regeln es geben soll, während in Deutschland ein zweijähriger Prozess angestrebt wird, indem es zunächst darum geht, zu fragen, was ist ein Bewusstsein? Erst nachdem man das festgelegt hat, wird es vielleicht Ansätze von Regelungen geben. In einem Fall geht man direkt von einem Phänomen zur Regel und hier in Europa, zumindest im deutschsprachigen Raum, fängt man an, über die Basis und den theoretischen Hintergrund nachzudenken. Für mich ist es extrem interessant, in beiden Welten zu leben.
medinlive: Einen globalen ethischen Rahmen zu finden scheint dann schwierig?
Knoblich: In dem Ausschuss sollen sehr praktische Handlungsanweisungen entstehen, die nach einer Abstimmung eins zu eins in wissenschaftliche Zeitungen kommen und zur Voraussetzung werden, dort publizieren zu dürfen. Ethische Regeln gibt es bereits jetzt. Hält man sich nicht daran, kann man nicht publizieren und wenn man nicht publizieren kann, ist es sinnlos, als Wissenschaftler Forschung zu betreiben. Auf diese Art und Weise kann man in diesem Bereich Regeln schaffen, die weltweit eine gewisse Gültigkeit haben. Wenn natürlich jemand auf die Idee kommt CRISPR/Cas9-Babys zu erzeugen, wie das in China geschehen ist, ist das ein anderes Thema. Aber es ist zumindest gut, dass die Reaktion der internationalen Forschungsgemeinschaft, ganz besonders von chinesischen Wissenschaftlern, so heftig war, dass der Forscher nun im Gefängnis sitzt.
medinlive: Können Sie Einblick geben, welche ethischen Regeln in diesem Komitee derzeit diskutiert werden?
Knoblich: Es geht etwa um die Zustimmung der Patienten. Es reicht nicht, dem Patienten zu sagen: Wir wollen Zellmaterial und forschen daran. Sondern man muss dezidiert sagen: Wir machen Organoide. Und dann genau erklären, was ein Organoid ist. Die Eltern eines Kindes, das unter einer schweren neurologischen Erkrankung leidet, könnten etwa sagen, dass das Gehirn des Kindes nicht nachgebaut werden darf. Die meisten Patienten sind kooperativ, sehen den Nutzen unserer Arbeiten und unterstützen daher diese Art der Forschung.
Dann geht es um Regeln, wie man mit Daten umgeht, die ja anonym sein müssen. Jetzt könnte ich in meinem Labor die DNS sequenzieren und herausfinden, wer der Patient war, was nicht erlaubt ist. Es gibt auch Regeln, die besagen, wie menschliche DNS Daten auf dem Computer abgesichert werden muss, ähnlich stark wie ein Bankkonto. Und es geht noch weiter. Eine Frage bei der wir uns noch nicht im Klaren sind: Was mache ich als Wissenschaftler, wenn ich herausfinde, dass ein bestimmtes Medikament für einen Patienten wirksam sein könnte? Da kann ich nicht mehr zurückgehen, weil alles anonym ist. Hierfür soll es einen Code geben, auf dem nach Konsens von Forscher und Arzt zurückgegriffen werden kann, wodurch der Arzt die Patienten wieder identifizieren und die Ergebnisse des Wissenschaftlers zurücktragen kann. Das sind die ethischen Probleme, die uns wirklich umtreiben.
medinlive: Sind auch Rechte von Organoiden oder eine Vormundschaft Thema der ethischen Debatte?
Knoblich: Nein, aber Fragen wie: Wem gehört das Organoid? Das ist ein problematisches Thema, denn lange Zeit galt die Meinung, dass die Zellen eines Patienten immer den Patienten gehören. In manchen Ländern geht man nun davon weg. Wenn ich jetzt zum Beispiel ein Haar auf der Straße verliere, an dem ja meine Zellen drauf sind, könnte ich den Straßenkehrer, der dieses Haar in die Müllverbrennungsanlage gebracht hat, wegen Körperverletzung anzeigen. Das ist natürlich völlig absurd! In der Forschung werden aber immer mehr iPS-Zellen hergestellt, deswegen ist das eine wichtige Frage. Ein fundamentales Prinzip von Forschung ist, dass andere meine Experimente nachmachen können. Wenn ich aber die Zellen nicht herausgeben darf, führt das dazu, dass viele Patienten benötigt werden und dass niemand Experimente nachmachen kann. Meiner Ansicht nach ist es wird sehr wichtig, sogenannte Biobanken aufzubauen, wo Zelllinien von gesunden und erkrankten Patienten gespeichert sind, die allen Wissenschaftlern weltweit zur Verfügung stehen. Am IMBA bauen wir eine solche Biobank für Österreich gerade auf. Mit Hilfe der Medizinischen Universität Wien zielen wir hierfür auf eine besondere Art von Zustimmung der Patienten ab und es braucht eine besondere Ethik, weil es wird so gut wie unmöglich sein, wenn der Patient nachträglich sagt: Ich möchte all die Zellen, die weltweit von mir im Umlauf sind, zurückhaben.
medinlive: Am IMBA sind einige Durchbrüche gelungen: 2013 mit der Entwicklung der ersten Gehirn-Organoide, 2018 mit den weltweit ersten Organoiden für Blutgefäße. Woran wird zurzeit gearbeitet?
Knoblich: Es ist uns gelungen an Organoiden zu zeigen, dass man auch Interaktionen von weit entfernt von einander liegenden Gehirnteilen nachmachen kann. Auch haben wir Tumor-Organoide erzeugt. Im Augenblick haben wir eine tolle Kooperation mit dem AKH-Wien, wo wir Organoide für Epilepsie erzeugen. Damit können wir den gesamten Mechanismus einer bestimmten Art von Epilepsie fundamental ändern. Wir haben neue Zelltypen entdeckt, die es nur beim Menschen gibt und nicht bei Tieren. Nähere Details kann ich noch nicht nennen, da die Arbeit noch nicht publiziert ist, aber die Ergebnisse werden hoffentlich viel Aufsehen erregen.
Meilensteine der Organoidforschung
2006 eröffnete Shinya Yamanaka, Biologe an der Universität Kyoto in Japan, einen neuen Weg zur Erforschung des menschlichen Gehirns. Er fand einen Cocktail aus vier Proteinen, die gewöhnliche Hautzellen in Stammzellen verwandeln können, die dann das Potenzial haben, sich in Neuronen, Muskeln oder Blutzellen zu verwandeln. Darauf aufbauend lernten andere Forscher, Stammzellen wie Miniaturorgane in einer Schale wachsen zu lassen. Organoide ermöglichen medizinische Tests, für die ansonsten Tierversuche herangezogen würden. In den vergangenen Jahren wurden unter anderem Modelle des Gehirns, des Herzens oder der Nieren angefertigt.
2013 gelang Forschern um Jürgen Knoblich vom Institut für Molekulare Biotechnologie (IMBA ) in Wien ein weiterer Durchbruch. Sie stellten erstmals, kleine, kurzlebige Hirnorganoide her (Lancaster und Knoblich, 2014). Gehirn-Organoide, bei denen sich menschliche Zellen in der Petrischale zu hirnähnlichen Strukturen formieren. Sie werden verwendet, um Schizophrenie und Autismus, Parkinson oder auch Augenerkrankungen zu untersuchen. 2018 wurden am IMBA die weltweit ersten Organoide für Blutgefäße entwickelt, die es nun ermöglichen, Volkskrankheiten wie Diabetes zielgerichtet zu studieren. Das IMBA ist das größte Institut der Österreichischen Akademie der Wissenschaften (ÖAW) und genießt mittlerweile Weltruf in der Stammzellforschung. Die Stammzellinitiative am IMBA wird durch eine Förderung des Bundesministeriums für Wissenschaft sowie durch die Stadt Wien finanziert.
Weiterlesen:
Hans Clevers vom Hubrecht Institut über den Einsatz von Organoiden in der Krebsforschung (Video)
Robert Vries vom Hubrecht Institut über Status quo in der Organoid-Technologie (Podcast)
Anwendungsmöglichkeiten in der Medizin (PDF) Dr. Georg Weitzer, Zentrum für Medizinische Biochemie, Max F. Perutz Laboratorien, Vienna BioCenter MedUni Wien, 2018
„Science Direct“-Artikel über die Ethik der Forschung an zerebralen Organoiden
„New York Times“-Artikel zu Gehirn-Organoiden
„The Guardian“-Artikel zur ethischen Debatte von Organoiden
„New York Times“-Artikel zu Alysson Muotri
Factsheet des sciencemediacenters zur Forschung an Mini-Tumoren